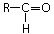
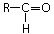
donde R es un átomo de hidrógeno (es el caso del metanal) o un radical hidrocarbonado alifático o aromático.
La mayoría de los aldehídos son solubles en agua y presentan puntos de ebullición elevados. El grupo carbonilo les proporciona una gran reactividad desde el punto de vista químico; dan ácidos carboxílicos con mucha facilidad. Los aldehídos se obtienen a partir de los alcoholes primarios, controlando el proceso para evitar que el aldehído pase a ácido.
Estos compuestos están presentes en muchas frutas, siendo responsables de su olor y sabor característicos, y tienen mucha importancia en la fabricación de plásticos, tintes, aditivos y otros compuestos químicos. Los dos primeros de la serie son el metanal y el etanal.
Cannizzaro, Stanislao (1826-1910), químico italiano, nacido en Palermo, que realizó una gran aportación a la teoría atómica al clarificar la distinción entre la masa atómica y la masa molecular. Después de participar en la revolución siciliana de 1848, Cannizzaro trabajó en un laboratorio de París (1849-1851). Fue nombrado profesor de química del Instituto de Alessandria en 1851 y de las universidades de Génova en 1855, Pisa en 1861 y Roma en 1871. En Alessandria descubrió la reacción que lleva su nombre: la reacción de Cannizzaro demuestra que los aldehídos tratados con álcali concentrado dan como resultado una mezcla de sus alcoholes y ácidos correspondientes; por ejemplo, un benzaldehído da alcohol bencílico y ácido benzoico.
Metanal o Formaldehído , compuesto de carbono, hidrógeno y oxígeno de fórmula HCHO o CH 2 O. Fue descubierto en 1867 por el químico alemán August Wilhelm von Hofmann. Es el más simple de los aldehídos. A temperatura normal es un gas de un olor penetrante. Puede ser comprimido hasta el estado líquido; su punto de ebullición es -21 °C. Su preparación industrial requiere calentar aire seco y vapor de alcohol metílico en presencia de un catalizador, como el cobre o la plata. No obstante se han desarrollado procesos más directos sintetizando metanal a partir de monóxido de carbono e hidrógeno. En uno de estos procesos, se pasa esta mezcla por un catalizador a una temperatura entre 200 y 300 °C, a una presión de 10,2 atmósferas. El metanal puro es muy reactivo y se polimeriza fácilmente.
La formalina es el nombre comercial de una solución que contiene un 40% de metanal y un 60% de agua, o de agua y alcohol metílico. Se utiliza como desinfectante, insecticida, fungicida y desodorante. El formaldehído se emplea en la industria química en grandes proporciones para sintetizar compuestos orgánicos, especialmente en la fabricación de resinas sintéticas. Estudios recientes han revelado su naturaleza cancerígena.
Acroleína , nombre común en química para el aldehído acrílico. La acroleína, cuya denominación sistemática es propenal, es el aldehído insaturado más sencillo, con fórmula estructural CH 2 9 CH-CHO. Este compuesto orgánico es un líquido incoloro, inflamable y muy tóxico, de olor punzante, con una temperatura de ebullición de 52 ºC. Debido al doble enlace carbono-carbono conjugado con la función carbonilo, la acroleína es muy reactiva y en estado puro tiende a la polimerización espontánea. Industrialmente, la acroleína se obtiene mediante oxidación catalítica del propeno y por deshidratación de la glicerina. Sin embargo, también aparece en pequeñas cantidades en cualquier combustión, y es responsable, por ejemplo, del olor penetrante de las grasas alimenticias y los aceites excesivamente calientes. En la industria química, la acroleína se utiliza en la fabricación de ácido acrílico y como sustancia de partida para muchas reacciones de síntesis orgánica.
Vainillina , sólido blanco con un olor fuerte a vainilla, de fórmula C 8 H 8 O 3 . Es un aldehído de carácter aromático, el 3-metoxi-4-hifroxibenzaldehído, que cristaliza en forma de agujas; es soluble en agua, alcohol y éter. Tiene un punto de fusión de 80 °C y presenta carácter ácido.
Se encuentra en muchos vegetales, sobre todo en la vaina de la vainilla. Industrialmente se obtiene a partir del eugenol, el constituyente principal de la esencia de clavo. También se obtiene por oxidación de la lignina, un polímero complejo que se encuentra en el tejido leñoso de las plantas.
La vainillina se utiliza mucho como agente aromatizante en alimentación, sobre todo en pastelería. También se emplea en la industria farmacéutica como estimulante gástrico, y en perfumería.
Cetona , cada uno de los compuestos orgánicos que contienen el grupo carbonilo (CO) y que responden a la fórmula general R—CO—R ¢ , en la que R y R ¢ representan radicales orgánicos.
Al grupo carbonilo se debe la disolución de las cetonas en agua. Son compuestos relativamente reactivos, y por eso resultan muy útiles para sintetizar otros compuestos; también son productos intermedios importantes en el metabolismo de las células. Se obtienen a partir de los alcoholes secundarios.
La cetona más simple, la propanona o acetona, CH 3 COCH 3 , es un producto del metabolismo de las grasas, pero en condiciones normales se oxida rápidamente a agua y dióxido de carbono. Sin embargo, en la diabetes mellitus la propanona se acumula en el cuerpo y puede ser detectada en la orina. Otras cetonas son el alcanfor, muchos de los esteroides, y algunas fragancias y azúcares.
Propanona o Acetona , líquido incoloro e inflamable, de fórmula CH 3 COCH 3 , el más sencillo de los productos químicos orgánicos denominados cetonas. La propanona, soluble en agua y en disolventes orgánicos, es por sí sola un importante disolvente que se utiliza tanto en el laboratorio como en la industria. También conocida como dimetilcetona, tiene un olor suave y agradable, y su punto de ebullición está en 56 °C, y el de fusión en -95 °C. Se emplea en grandes cantidades como disolvente para el etanoato de celulosa en la producción del rayón y como agente gelatinizante en explosivos. La propanona también se utiliza como ingrediente en disolventes de barnices y para disolver gomas y resinas. Es también el disolvente usado en pegamentos de goma y en líquidos de limpieza.
La propanona puede obtenerse en laboratorio mediante la oxidación del
2-propanol, calentando etanoato de calcio o fermentando azúcar con
determinadas bacterias. Actualmente la mayor parte se elabora mediante el
proceso de Hock, que utiliza benceno y propeno para producir propanona y fenol.
En los aldehídos se sustituye la terminación -o de los hidrocarburos por -al y la cadena se comienza a numerar por el extremo que lleva el grupo carbonilo (C=O).
Las cetonas se nombran cambiando la terminación -o del hidrocarburo por -ona, y la posición del grupo carbonilo se indica con un localizador.
Un aldehído y una cetona están en equilibrio con su correspondiente enol. La posición de este equilibrio depende de la estructura del compuesto y de ciertas condiciones, como la temperatura, la concentración o el disolvente.
Las formas cetónica y enólica de un compuesto son moléculas distintas; en ningún caso se deben confundir con formas de resonancia, que no tienen existencia real independiente. Para describir la relación entre las formas cetónica y enólica se ha utilizado un nombre especial: se denominan tautómeros entre sí y su interconversión se llama tautomería.
En los aldehídos y cetonas sencillos, el equilibrio está ampliamente desplazado hacia la forma cetónica, mientras que en los compuestos 1,3-dicarbonílicos predomina la forma enólica. Esto es debido a la estabilización por conjugación del doble enlace carbono-carbono del enol con el segundo grupo carbonilo y, cuando es posible, a la formación de un enlace de hidrógeno interno.
Tautomería , transposición que consiste en la migración de un protón de un lugar a otro de una molécula, originando dos tautómeros que están en equilibrio y no se pueden aislar.
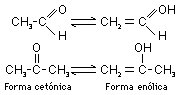
Las reacciones de transposición o de reordenamiento consisten en cambios de estructura en una misma molécula, sin que haya ni salida ni entrada de nuevos átomos o grupos en la estructura. Éste es el caso de la tautomería de aldehídos y cetonas que tienen dos formas de su estructura en equilibrio inseparables:
Las formas cetónica y enólica son moléculas distintas, y no deben confundirse con formas de resonancia que no tienen existencia real independiente. Las formas cetónica y enólica se denominan tautómeros entre sí y su interconversión es una tautomería. Los tautómeros son fácil y rápidamente interconvertibles en condiciones ordinarias. En aldehídos y cetonas sencillos los equilibrios tautómeros están desplazados hacia la forma aldehído y cetona; en los compuestos dicarbonílicos conjugados (posición 1,3 o 2,4) la presencia de la forma enólica puede llegar hasta el 80%.
Por deshidrogenación, con un catalizador de cobre, de alcoholes primarios y secundarios se obtienen aldehídos y cetonas, respectivamente.